This website uses cookies so that we can provide you with the best user experience possible. Cookie information is stored in your browser and performs functions such as recognising you when you return to our website and helping our team to understand which sections of the website you find most interesting and useful.
Košickí vedci v Nature Medicine. Zastavia degeneráciu neurónov aj u človeka?

Prof. Martin Maršala v experimentálnej operačnej sále. (zdroj: AV ČR) / Prof. Martin Marsala in experimental surgery room. (source: AS CR)
V najnovšom čísle prestížneho časopisu Nature Medicine boli publikované výsledky medzinárodného tímu, ktorého súčasťou boli aj výskumníci z košických pracovísk SAV, a ktoré majú obrovský význam pre potenciálnu terapiu doteraz neliečiteľnej neurodegeneratívnej choroby – amyotrofickej laterálnej sklerózy.
Štúdia vznikla na University of California San Diego School of Medicine, kde hlavným autorom štúdie a vedúcim výskumného tímu je profesor Martin Maršala, MD z Oddelenia anesteziológie na Lekárskej fakulte UC San Diego. Prof. Martin Maršala začínal na Neurobiologickom ústave SAV v Košiciach, kde stále pôsobí ako vedecký spolupracovník a poradca. Neurobiologický ústav je v súčasnosti súčasťou Biomedicínskeho centra SAV (BMC SAV).
Zo Slovenska na štúdií spolupracovali MVDr. Ivo Vanický, CSc. z Neurobiologického ústavu BMC SAV a doc. Ing. Zoltán Tomori, CSc. z Ústavu experimentálnej fyziky SAV.

Nature Medicine
Čo je amyotrofická laterálna skleróza
Amyotrofická laterálna skleróza (ALS) je neurodegeneratívne ochorenie, ktoré vedie k poškodeniu nervových buniek v mozgu a mieche. Do povedomia verejnosti sa ALS dostala vďaka výzve na sociálnych sieťach „Ice bucket chalenge“, kedy sa ľudia oblievali ľadovou vodou a zároveň prispievali na výskum a liečbu tejto choroby. Pri ALS sú postihnuté najmä motorické neuróny zodpovedné za pohyb, s následnou progresívnou stratou schopnosti ovládať svaly, čo ovplyvňuje schopnosť hovoriť, jesť, pohybovať sa a dýchať. V súčasnosti existuje iba symptomatická liečba príznakov ochorenia, ktorému väčšina pacientov podľahne v priebehu 2 – 5 rokov po diagnóze.
Existujú dve formy ALS, sporadická a familiárna. Sporadická forma je najbežnejšou formou, ktorá predstavuje 90 až 95 percent všetkých prípadov. Môže sa vyskytnúť náhodne u kohokoľvek.
Familiárna forma ALS predstavuje 5 až 10 percent všetkých prípadov a prenáša sa dedične.
Predchádzajúce štúdie ukazujú, že s ALS je spojených najmenej 200 mutácií génu nazývaného SOD1. Tento gén v bunke kóduje tvorbu enzýmu nazývaného superoxiddismutáza, ktorý bunka používa na štiepenie superoxidových radikálov – toxických kyslíkových molekúl produkovaných ako vedľajší produkt normálnych bunkových procesov. Mutácie génov SOD1 môžu znížiť účinnosť odstraňovania superoxidových radikálov, alebo viesť k tvorbe ďalších toxických látok, ktoré následne poškodzujú motorické nervové bunky, čo vedie k ALS.
Možnosti terapie ALS
Génovou terapiou je teoreticky možné vypnúť, alebo potlačiť aktivitu daného génu. Pri tejto terapii je potrebné aplikovať do nervového tkaniva vírus (vektor), ktorý do bunky potrebnú genetickú informáciu dopraví. V predošlých experimentoch sa skúšalo podávanie takéhoto vírusu vnútrožilovo alebo do mozgovomiechového moku u myší s prejavmi včasného štádia ALS. Takáto liečba dokázala spomaliť postup ochorenia, ktoré však napriek liečbe pokračovalo a myši čoskoro uhynuli.
Originalita tejto štúdie je v novom prístupe ako účinne podať vírus, ktorý dokáže vypnúť gén spôsobujúci ALS. Vírus bol podávaný subpiálne, t. j. pod vrstvu „pia mater“, čo je jemná najvnútornejšia membrána obaľujúca mozog a miechu. Vedci zistili, že takéto jednorazové podanie liečebného vektora zastavilo neurodegeneráciu u myší, u ktorých sa ešte príznaky ALS nestihli prejaviť, a ktoré vykazovali normálne neurologické funkcie bez zistiteľného nástupu ochorenia. U dospelých myší, ktoré už mali príznaky podobné ALS, subpiálna injekcia účinne zastavila ďalší rozvoj ochorenia. V obidvoch prístupoch postihnuté myši žili bez ďalších negatívnych vedľajších účinkov po celú dobu štúdie, ktorá presahovala až jeden rok po podaní terapie.
„V súčasnosti poskytuje tento terapeutický prístup najúčinnejšiu terapiu, aká sa kedy preukázala na myších modeloch ALS spojenej s mutovanou SOD1,“ uviedol hlavný autor Martin Maršala. „Okrem toho účinnosť takejto liečby u dospelých zvierat naznačuje, že nový spôsob podávania liečby by mohol byť účinný aj pri liečbe iných neurodegeneratívnych porúch, kde je potrebné dopraviť génovú terapiu do tkaniva miechy.“
Príspevok ústavov SAV
Každá terapia, ktorá spomalí alebo zabráni úbytku nervových buniek a nervových vláken, dokáže predĺžiť život pacienta. Počet funkčných nervových vláken vedúcich informáciu ku svalom je teda jedným z kľúčových kritérií úspešnosti terapie. Hodnotenie počtu a distribúcie zachovaných nervových vláken v mieche a nervoch bola úloha výskumníkov slovenskej časti výskumného tímu.
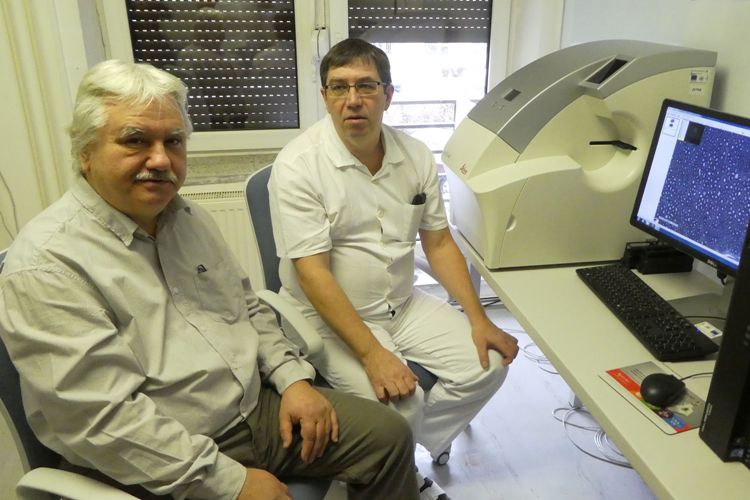
Zľava doprava – doc. Tomori a Dr. Vanický pri diskusii o spôsobe analýzy vzoriek. (zdroj: SAV)
Dlhoročný spolupracovník a kolega prof. Maršalu z Neurobiologického ústavu BMC SAV v Košiciach MVDr. Ivo Vanický, PhD. v rámci svojho výskumného projektu regenerácie periférneho nervu zaviedol a zoptimalizoval metódu na farbenie a identifikáciu vláken v nerve. Túto metódu použil aj na vzorky tkaniva z projektu prof. Maršalu.
Analýza počtu a distribúcie tisícok vláken v každej vzorke miechy alebo nervu, ktorých boli v danom experimente desiatky, by nebola možná bez účinného nástroja. Takýmto nástrojom je špecializovaný softvér na analýzu obrazu NeuroCounter, ktorý pre účely analýzy vláken vytvoril doc. Ing. Zoltán Tomori, CSc. z Ústavu experimentálnej fyziky SAV v Košiciach, ktorý s profesorom Maršalom spolupracuje tiež dlhšie obdobie. Tento softvérový nástroj je voľne dostupný aj pre ostatných výskumníkov.
Analýza počtu a distribúcie prežívajúcich nervových vláken je významnou súčasťou výsledkov a argumentácie danej práce, čoho dôkazom je skutočnosť, že Dr. Vanický, doc. Tomori a SAV sú súčasťou autorského kolektívu.
Ďalší výskum
Výskumný tím skúšal tento nový postup aj u dospelých ošípaných, ktorých rozmery miechy sú podobné ako u ľudí. Pri použití injekčného zariadenia vyvinutého na použitie u dospelých ľudí zistili, že postup sa dá vykonávať spoľahlivo a bez chirurgických komplikácií.
Ďalšie kroky zahŕňajú štúdie bezpečnosti na veľkom zvieracom modeli s cieľom určiť optimálnu a bezpečnú dávku liečebného vektora. Zatiaľ čo u myší viac ako rok po liečbe neboli pozorované žiadne zistiteľné vedľajšie účinky súvisiace s liečbou, je nevyhnutné definovať bezpečnostné limity liečby na veľkých experimentálnych zvieratách, čo je podmienka pre prenos tohto spôsobu liečby do klinického testovania.
Poďakovania
Financovanie výskumu bolo z projektov Nadácie ALSA, Ministerstva školství, mládeže a tělovýchovy České republiky, Agentúry na podporu výskumu a vývoja (APVV), Vedeckej grantovej agentúry Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky, a Slovenskej akadémie vied (VEGA), Grantové agentury České republiky, Amerického národného ústavu zdravia (National Institutes of Health – grant R01-EB024015) a Kalifornského ústavu pre regeneratívnu medicínu (California Institute for Regenerative Medicine – grant LA1-C12-06919).
Linky na text publikácie:
https://www.nature.com/articles/s41591-019-0674-1








